
1、预测项目潜在投标单位,提前了解潜在投标单位的项目竞争力;
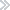
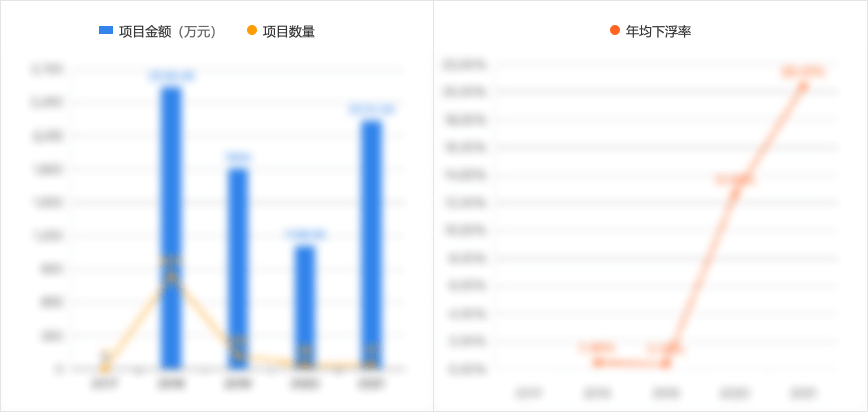
2、分析招标单位同类项目成交价格、规模趋势,让投标报价更加科学精准;
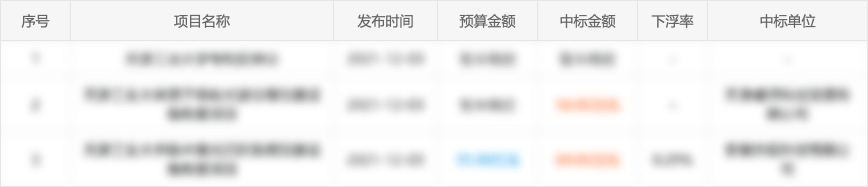
3、分析招标单位同类项目历史合作方,快速了解您的竞争对手;
4、洞悉同类项目主要供应商市场占有量,全面掌握市场最新最新动态。
说明:支付即代表同意《比地招标网线上购买与服务条款》 如有疑问请联系客服:400-999-4928
温馨提示:支付成功后,可联系客服开具发票哦~
温馨提示:支付成功后,可联系客服开具发票哦~

恭喜您,下载成功!
数据将在5分钟内发送至您的邮箱
,请注意查收!
如需开具发票请联系客服:400-999-4928
创建订单中...


企业分析报告是什么?
企业报告是通过海量招标采购项目信息和企业主体信息,多维度分析企业招投标市场规模、业务分布、关联主体、违规失信风险情况的实时企业大数据报告。
1、帮助您分析招标单位的项目规模趋势和预算节约率,为企业开发客户、投标报价提供参考,让投标更有针对性;
2、帮助您分析招标单位的采购行业品类,帮助企业拓宽相关业务;
3、帮助您分析招标单位的主要合作供应商和合作代理机构,帮助企业了解同行竞争实力水平,结合供应商报告定位自身企业优劣势,找到更多商机;
4、帮助您分析招标单位的违规失信风险,提高自身风险防范能力。
1、帮助您分析同行或者自身的中标金额趋势、项目规模和报价下浮率,为企业投标、报价提供参考,让投标决策更合理;
2、帮助您分析企业的招投标区域优劣势,扬长避短赢得更多市场机会;
3、帮助您分析企业的主要竞争对手、主要合作业主,从竞争对手、合作业主的优劣势比较中,找到自身企业优势和合作商机;
4、帮助您分析企业最新的信用风险记录,为企业投诉,维护自身合法竞争权益提供参考线索。
1、帮助您了解代理机构项目概况、业主发展趋势、项目结构等基本情况,为招投标市场拓展提供参考;
2、帮助您了解代理机构的项目分布情况(包括采购系统和地区),分析目标企业的市场占比,寻找更多市场机会;
3、帮助您了解代理机构所代理的项目预算节约度,从而分析与目标企业的服务差距,优化自身服务能力;
4、帮助您了解代理机构的重点客户情况,帮助企业了解同行的合作情况,提高自身竞争力;
5、帮助您了解代理机构的各项经营风险,防范自身信用风险,提高风险防范能力。

- 近一年
- 近两年
- 近三年
说明:支付即代表同意《比地招标网线上购买与服务条款》 如有疑问请联系客服:400-999-4928
温馨提示:支付成功后,可联系客服开具发票哦~
温馨提示:支付成功后,可联系客服开具发票哦~

恭喜您,下载成功!
数据将在5分钟内发送至您的邮箱
,请注意查收!
创建订单中...



 放大
放大 缩小
缩小
 公告内容:
公告内容:
各疫苗企业:
根据《****省卫生健康委员会 ****省医疗保障局非免疫规划疫苗挂网阳光采购职责备忘录》文件有关要求,经报请省卫生健康委和省医保局同意,按照工作流程,目前组织开展****年非免疫规划疫苗增补挂网阳光采购资质审核工作。现就非免疫规划疫苗基础信息资质材料提交相关事宜通知如下。
*、资质审核对象
****省药械招标采购服务中心提供的非免疫规划疫苗增补采购报名对象,详见****年非免疫规划疫苗增补产品及企业报名信息(附件*)。
*、提交资质要求
(*)内容要求
详见基础信息资质材料内容要求(附件*)。
(*)格式要求
*.企业根据报名信息情况,填写《****省非免疫规划疫苗挂网阳光采购企业和产品资质审核表》(附件*),**纸打印,内容较多可正反双面打印。
*.基础信息资质材料统*用**纸双面复印、打印,分为企业册和产品册,根据非免疫规划疫苗资质材料格式模板(附件*)的内容和顺序要求,使用**孔装订夹条(建议资料页数在**页以下使用规格:***;**~***页使用规格:****;***页以上资料使用规格:**.***,请适当预留补充资料添加空间)装订成册并进行密封。按照附件*准备法定代表人授权书。
*.申报材料要完整清晰,并逐页加盖企业鲜章,其中所有外文资料均需提供相应的中文翻译文本并经公证部门公证。
(*)递交要求
*.****省非免疫规划疫苗挂网阳光采购企业和产品资质审核表(附件*)加盖企业鲜章单独递交。
*.企业册和产品册分别密封递交,待专家审核时,当场拆封。
*、资质材料递交时间与地点
(*)资质材料递交时间:****年*月**-**日,上午**∶**-**∶**、下午**∶**-**∶**。
(*)地点:****省疾病预防控制中心业务楼*栋*楼大厅(****省****市****区中学路*号)
(*) 联系人:**** 联系电话:***-********
*、注意事项
(*)同*注册批件的同*品规只能由*个申报主体进行申报并递交资质材料。
(*)****相关事项请企业及时关注网站信息。
附件* ****年非免疫规划疫苗增补产品及企业报名信息.***
附件* ****省非免疫规划疫苗挂网阳光采购企业产品资质审核表.****
****省疾病预防控制中心
****年*月**日
 项目公告
项目公告


 功能介绍
功能介绍








 换一批
换一批






 潜在投标单位
潜在投标单位












 您当前为:
您当前为:










